| |
| Med Sci (Paris). 2009 November; 25(11): 973–976. Published online 2009 November 15. doi: 10.1051/medsci/20092511973.Un Nobel centenaire célèbre télomères et télomérase J. Arturo Londoño-Vallejo* Laboratoire Télomères et Cancer, UMR3244-Pavillon Trouillet-Rossignol, Institut Curie, 26, rue d’Ulm, 75248 Paris Cedex 05, France |
Les télomères (du grec telos : partie située à l’extrémité) sont les structures terminales des chromosomes linéaires, nécessaires pour perpétuer cette linéarité et assurer une réplication complète du matériel génomique. Aucune autre structure du génome n’a été autant, ni aussi directement, impliquée dans ces processus fondamentaux que constituent le vieillissement et le cancer. Ce prix couronne une grande avancée scientifique dont les applications potentielles, bien identifiées, restent encore à développer de façon pratique. Cela ne se fera pas sans fournir des efforts supplémentaires en recherche fondamentale et en recherche clinique. |
De l’hypothèse à la démonstration L’existence des télomères et leur fonction de protection chromosomique ont été proposées dans les années 1930, indépendamment, par Hermann Muller [
1] et Barbara McClintock [
2], mais leur composition et leur métabolisme sont restés énigmatiques. Le mystère lié aux télomères est revenu sur le devant de la scène scientifique au début des années 1970 car leur mode de réplication ne pouvait pas être expliqué par les mécanismes découverts jusqu’alors. De ce fait, James Watson a prédit que les extrémités des molécules d’ADN linéaire devaient raccourcir à chaque cycle de réplication (le end replication problem) [
3]. Au même moment, Alexei Olovnikov a fait le premier rapprochement entre ce problème de réplication terminale et la capacité limitée de prolifération des cellules humaines maintenues in vitro [3], appelée sénescence mitotique et observée par Leonard Hayflick une décennie auparavant [
5]. C’est en étudiant la structure de gènes ribosomaux extrachromosomiques de Tetrahymena thermophila, un protozoaire cilié, qu’Elizabeth Blackburn a mis en évidence, pour la première fois, le caractère répété des séquences télomériques ainsi que leur biais en composition nucléotidique, avec un brin orienté de 5’ vers 3’ riche en guanines [
6]. De façon remarquable, cet arrangement sera retrouvé presque de façon systématique chez toutes les espèces examinées par la suite. Peu de temps après, en collaboration avec Jack Szostak, Elizabeth Blackburn utilise ces séquences terminales de Tetrahymena pour démontrer expérimentalement qu’elles sont suffisantes pour jouer le rôle de protection et de réplication des extrémités de mini-chromosomes dans la levure de boulanger, Saccharomyces cerevisiae [
7]. De plus, ces séquences étaient utilisées comme substrat par la levure pour ajouter à son tour des répétitions télomériques spécifiques à cet organisme, indiquant ainsi l’existence d’un mécanisme consacré à l’addition des nucléotides à l’extrémité des chromosomes. Pendant les années qui suivirent, Elizabeth Blackburn et Carol Greider (son étudiante de thèse à l’époque) ont appliqué une approche biochimique pour identifier et purifier l’enzyme responsable de la synthèse de novo des télomères chez Tethrahymena [
8]. Ce laboratoire a ensuite montré que cette enzyme, initialement appelée transférase terminale télomérique, puis définitivement baptisée télomérase, utilisait une matrice d’ARN (dont le gène a été par la suite identifié) pour l’addition de répétitions à l’extrémité des télomères [8]. De son côté, le laboratoire de Jack Szostak a introduit une approche génétique pour rechercher des mutations capables d’affecter la maintenance des télomères chez la levure tout en induisant un phénotype de sénescence [
9]. La caractérisation de ces mutants (appelés « Est » pour ever shorter telomeres - des télomères toujours plus courts) a été capitale dans l’identification de nombreux facteurs télomériques, posant les bases du paradigme expérimental dans ce domaine. |
En même temps que ces observations expérimentales étaient rapportées, la séquence télomérique chez l’homme a été identifiée [
10] et un raccourcissement télomérique a été observé dans des cellules cultivées in vitro et associé à l’entrée des cellules en sénescence [
11]. Un raccourcissement a également été observé dans des lymphocytes de sang périphérique chez des personnes âgées [
12] et une activité télomérase a été démontrée dans des cellules tumorales humaines [
13], deux observations appuyant l’hypothèse d’un rôle fondamental des télomères et de la télomérase dans les processus de vieillissement et d’immortalisation (Figure 1). L’identification du gène de la télomérase humaine [
14,
15] a permis la mise en place d’expériences prouvant qu’il suffit d’empêcher les télomères de raccourcir pour obtenir l’immortalisation des cellules humaines in vitro [
16]. Par ailleurs, la mise en évidence d’une activité télomérase dans la très grande majorité des tumeurs chez l’homme [
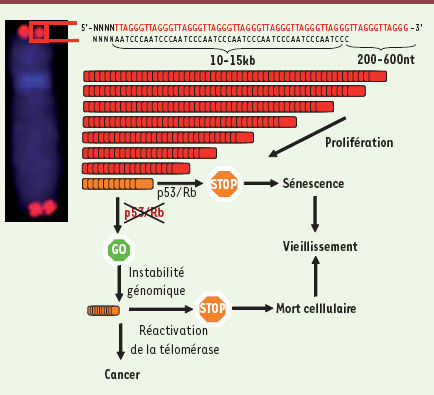
17] a confirmé la place centrale que joue la conservation de la longueur des télomères dans le processus de tumorigenèse.  | Figure 1.
Les extrémités des chromosomes linéaires contiennent plusieurs milliers de répétitions TTAGGG qui sont reconnues par un complexe protéique spécifique, appelé shelterin (non représenté sur le dessin). La fonction de protection exercée par les télomères dépend de la longueur de la portion double brin, de la présence d’une portion terminale simple brin et de l’intégrité du complexe shelterin. La très grande majorité de cellules somatiques ne possèdent pas d’activité télomérase, si bien que les télomères raccourcissent à chaque division cellulaire. Lorsque les télomères sont trop courts pour assurer une protection, une signalisation (dépendante de p53 et/ou Rb) se met en route pour commander l’arrêt de la prolifération cellulaire. La cellule entre en sénescence mitotique, ce qui peut contribuer aux manifestations de vieillissement. Si la voie de signalisation est inactivée, les cellules continueront de se diviser, ce qui provoque un dysfonctionnement télomérique et une instabilité chromosomique généralisés, entraînant la mort cellulaire. Si la télomérase est réactivée, les télomères sont allongés à nouveaux permettant l’immortalisation cellulaire caractéristique des cellules cancéreuses. |
L’avènement des modèles murins transgéniques a permis au groupe de Carol Greider (en collaboration avec le groupe de Ronald DePinho) de créer des souris dépossédées d’activité télomérase [
18]. Malgré ce défaut, ces souris se développent normalement tant que leurs télomères restent suffisamment longs. Cependant, leurs télomères raccourcissent au fur et à mesure des générations et finissent par provoquer soit des manifestations de vieillissement prématuré, lorsque le contexte est par ailleurs normal, soit une prédisposition aux cancers, lorsque s’y associe un gène p53 (suppresseur de tumeurs) muté. De nombreuses études ont suivi, exposant de manière définitive ces deux aspects du dysfonctionnement télomérique. |
Mythes et réalités des télomères et de la télomérase Au cours de ces dernières années, malgré les énormes progrès de nos connaissances sur les aspects fondamentaux du fonctionnement télomérique et de l’activité télomérase, leurs applications en médecine semblent encore lointaines. Nous savons que la réactivation de la télomérase lors du développement tumoral constitue un événement clé (mais il n’est pas le seul) de la progression vers des formes agressives. Cependant, nous ne savons pas encore comment prévenir cette réactivation. La recherche des molécules qui pourraient contrecarrer l’action de la télomérase se poursuit très activement mais avec des résultats plutôt maigres (à notre connaissance, seule une molécule est actuellement testée dans les essais cliniques de phase III mais les conclusions ne sont pas encore disponibles). Le développement d’un vaccin anti-télomérase est dans ses premières étapes de validation expérimentale [
19]. Une approche alternative dans la lutte anti-cancer prendrait comme cible non plus la télomérase, mais les télomères, en induisant une déstabilisation de ces structures dans les cellules tumorales, et par là même en les empêchant de se diviser [
20]. Nombreuses sont les molécules actuellement à l’étude, mais rares sont celles dotées d’une spécificité suffisante pour mener à bien ces tâches. Surtout, mais ceci n’est pas l’apanage des thérapies anti-télomères/télomérase, nous ne savons pas diriger ces activités vers les cellules cancéreuses et ainsi épargner les tissus sains. Un aspect très important de la biologie des télomères, et peut-être celui qui a fait couler le plus d’encre et qui fait rêver le plus de monde, est son rôle potentiel dans le vieillissement. Ce rôle, démontré très élégamment dans les modèles expérimentaux et notamment chez la souris, reste moins bien compris chez l’homme. Néanmoins, l’étude des malades atteints de dyskératose congénitale, qui sont porteurs de mutations affectant directement l’activité télomérase ou la structure télomérique, a clairement démontré le lien qui existe entre le défaut de maintenance télomérique et l’apparition des manifestations de vieillissement prématuré [
21,
29]. Ces malades présentent aussi une incidence accrue de carcinomes [
22], le type de cancer le plus fréquemment détecté chez les personnes âgées. Par ailleurs, il existe maintenant une entité clinique nommée « syndrome des télomères courts » qui recouvre des défaillances organiques (dysfonctionnement hépatique, fibrose pulmonaire, anémie aplasique) associées à la présence, constitutive, des télomères plus courts que dans la population normale [
23]. Puisqu’il s’agit d’une déficience (et non d’une absence) d’activité télomérase, il suffirait, en théorie, de stimuler cette activité (ou d’apporter une copie normale du gène) pour restaurer un fonctionnement télomérique normal. Malheureusement, une telle molécule n’est pas encore disponible. Quant à la thérapie génique, elle se heurte encore à d’importants obstacles techniques et éthiques. Au-delà de ce qui est considéré comme manifestement pathologique, l’étude de certains types de populations a aussi mis en évidence des liens entre des styles de vie et des fonctions télomériques. En l’occurrence, des télomères courts ou une activité télomérase plus faible ont été retrouvés chez des personnes soumises à des stress psychologiques importants et continus (par exemple, prise en charge d’un proche avec une maladie chronique [
24]) mais sans pathologie associée. Ces travaux, auxquels Elizabeth Blackburn est directement associée, nous suggèrent un impact direct des fonctions psychologiques sur le métabolisme télomérique, contribuant par ce biais aux méfaits (ou bienfaits) de nos choix de vie. Mais la question reste encore posée : existe-t-il un lien entre télomères plus longs (ou activité télomérase accrue) et longévité ? Des expériences menées récemment chez la souris, chez lesquelles des copies surnuméraires du gène de la télomérase ont été introduites, suggèrent une réponse positive à cette question [
26]. Cependant, dans ce contexte, il a fallu renforcer la protection anti-tumorale avant que les souris montrent une augmentation significative de la survie. Chez l’homme, des associations entre télomères courts et mortalité précoce [26], ainsi qu’entre télomères plus longs et longévité [
27], ont parfois été rapportées sans qu’il soit possible (pour l’instant) de conclure définitivement. |
Reprogrammer pour perpétuer Les travaux fondamentaux des lauréats de cette année continuent d’alimenter nos espoirs de trouver des solutions vis-à-vis des pathologies du vieillissement, y compris le cancer. Cependant, notre compréhension des mécanismes de base liant la télomérase et les télomères à la vie cellulaire et à celle de l’être humain reste très imparfaite. C’est le double visage des télomères, côté pile promouvant la sénescence cellulaire et le vieillissement de l’organisme, côté face encourageant la prolifération désordonnée et la tumorigénicité (justifiant pleinement le mot d’Elizabeth Blackburn en parlant des télomères : Dr Jekyll et Mr Hyde) qui introduit l’incertitude et les risques d’éventuelles interventions. L’étude du métabolisme télomérique et du contrôle de l’expression de la télomérase dans des cellules souches embryonnaires pourrait apporter des éléments de réponse essentiels pour contrôler ces risques. En effet, les cellules souches embryonnaires sont immortelles, tout en obéissant à des programmes génétiques bien définis. L’accès à ce type de matériel biologique étant strictement réglementé, la récente apparition de la technologie de reprogrammation de cellules somatiques permet relativement facilement de contourner l’obstacle. Il semblerait, mais cela est en cours de vérification chez l’homme, que les cellules reprogrammées présentent un métabolisme télomérique similaire à celui des cellules souches embryonnaires [
28]. C’est donc l’occasion tant espérée d’étudier des cellules humaines naturellement dotées d’un fonctionnement télomérique perpétuel. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Muller H. The remaking of chromosomes. Collecting Net 1938; 13 : 181–98. 2. McClintock B. The behavior in successive nuclear divisions of a chromosome broken at meiosis. Proc Natl Acad Sci USA 1939; 25 : 405–16. 3. Watson JD. Origin of concatemeric T7 DNA. Nat New Biol 1972; 239 : 197–201. 4. Olovnikov AM. A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon. J Theor Biol 1973; 41 : 181–90. 5. Hayflick L, Moorhead PS. The serial cultivation of human diploid cell strains. Exp Cell Res 1961; 25 : 585–621. 6. Blackburn EH, Gall JG. A tandemly repeated sequence at the termini of the extrachromosomal ribosomal RNA genes in Tetrahymena. J Mol Biol 1978; 120 : 33–53. 7. Szostak JW, Blackburn EH. Cloning yeast telomeres on linear plasmid vectors. Cell 1982; 29 : 245–55. 8. Greider CW, Blackburn EH. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. Cell 1985; 43 : 405–13. 9. Lundblad V, Szostak JW. A mutant with a defect in telomere elongation leads to senescence in yeast. Cell 1989; 57 : 633–43. 10. Moyzis RK, Buckingham JM, Cram LS, et al. A highly conserved repetitive DNA sequence, (TTAGGG)n, present at the telomeres of human chromosomes. Proc Natl Acad Sci USA 1988; 85 : 6622–6. 11. Harley CB, Futcher AB, Greider CW. Telomeres shorten during ageing of human fibroblasts. Nature 1990; 345 : 458–60. 12. Hastie ND, Dempster M, Dunlop MG, et al. Telomere reduction in human colorectal carcinoma and with ageing. Nature 1990; 346 : 866–8. 13. Morin GB. The human telomere terminal transferase enzyme is a ribonucleoprotein that synthesizes TTAGGG repeats. Cell 1989; 59 : 521–9. 14. Lingner J, Hughes TR, Shevchenko A, et al. Reverse transcriptase motifs in the catalytic subunit of telomerase. Science 1997; 276 : 561–7. 15. Meyerson M, Counter CM, Eaton EN, et al. hEST2, the putative human telomerase catalytic subunit gene, is up-regulated in tumor cells and during immortalization. Cell 1997; 90 : 785–95. 16. Bodnar AG, Ouellette M, Frolkis M, et al. Extension of life-span by introduction of telomerase into normal human cells. Science 1998; 279 : 349–52. 17. Kim NW, Piatyszek MA, Prowse KR, et al. Specific association of human telomerase activity with immortal cells and cancer. Science 1994; 266 : 2011–5. 18. Blasco MA, Lee HW, Hande MP, et al. Telomere shortening and tumor formation by mouse cells lacking telomerase RNA. Cell 1997; 91 : 25–34. 19. Liu JP, Chen W, Schwarer AP, Li H. Telomerase in cancer immunotherapy. Biochim Biophys Acta 2009. 20. De Cian A, Lacroix L, Douarre C, et al. Targeting telomeres and telomerase. Biochimie 2008; 90 : 131–55. 21. Vulliamy T, Marrone A, Szydlo R, et al. Disease anticipation is associated with progressive telomere shortening in families with dyskeratosis congenita due to mutations in TERC. Nat Genet 2004; 36 : 447–9. 22. Alter BP, Giri N, Savage SA, Rosenberg PS. Cancer in dyskeratosis congenita. Blood 2009; 113 : 6549–57. 23. Armanios M. Syndromes of telomere shortening. Annu Rev Genomics Hum Genet 2009; 10 : 45–61. 24. Epel ES, Blackburn EH, Lin J, et al. Accelerated telomere shortening in response to life stress. Proc Natl Acad Sci USA 2004; 101 : 17312–5. 25. Tomás-Loba A, Flores I, Fernández-Marcos PJ, et al. Telomerase reverse transcriptase delays aging in cancer-resistant mice. Cell 2008; 135 : 609–22. 26. Cawthon RM, Smith KR, O’Brien E, et al. Association between telomere length in blood and mortality in people aged 60 years or older. Lancet 2003; 361 : 393–5. 27. Halaschek-Wiener J, Vulto I, Fornika D, et al. Reduced telomere length variation in healthy oldest old. Mech Ageing Dev 2008; 129 : 638–41. 28. Marion RM, Strati K, Li H, et al. Telomeres acquire embryonic stem cell characteristics in induced pluripotent stem cells. Cell Stem Cell 2009; 4 : 141–54. 29. Hoareau-Aveilla C, Henry Y, Leblanc T. La dyskératose congénitale : une maladie méconnue due à un maintien défectueux des télomères. Med Sci (Paris) 2008; 24 : 390–8. |